超详细的3T3-L1细胞成脂诱导操作指南
3T3-L1细胞是一种小鼠胚胎成纤维细胞系,最早于1974年由Green和Kehinde等人从小鼠胚胎中分离得到。由于其具备在体外分化为类脂肪细胞的能力,这种细胞系被广泛应用于肥胖和糖尿病等代谢性疾病的研究中。
本期细胞学堂将详细解读3T3-L1细胞的成脂诱导分化步骤及注意事项,帮助您轻松掌握实验技巧,确保实验顺利进行。
本次实验使用代次为P5的细胞进行诱导分化,但具体以当下的细胞状态为准。为了确保实验结果的准确性和可靠性,建议尽量使用早代次的细胞开始诱导分化实验。
注:此次3T3-L1细胞成脂诱导实验是普诺赛内部测试数据,仅供参考。
3T3-L1细胞成脂诱导分化步骤
(以六孔板为例)
1、3T3-L1(小鼠胚胎成纤维细胞)正常培养,细胞的融合度达到80~90%时,即可用胰酶消化,计数。
2、按2~3×104 cells/cm2的细胞密度接种在六孔板中(具体接板数量以实际预实验情况为准),每孔加入2 mL的3T3-L1细胞完全培养基。
3、将均匀接种好的3T3-L1细胞置于37℃,5% CO2的培养箱中进行培养。
4、当细胞融合度达到90%~95%时,小心的将孔内完全培养基吸走,向六孔板中加入2 mL的3T3-L1细胞成脂诱导分化培养基A液开始诱导。
5、A液诱导2天后,吸走六孔板的诱导完全培养基,每孔加入2 mL 3T3-L1(小鼠胚胎成纤维细胞)成脂诱导分化培养基B液完全培养基维持培养1天。
6、使用A 2天+B 1天交替的方法持续诱导。
7、诱导试剂配制方法可参考3T3-L1 (小鼠胚胎成纤维细胞) 成脂诱导分化培养基的说明书,并按照说明书操作对诱导结束后的细胞进行油红O染色。
诱导分化结果展示
3T3-L1细胞诱导前,细胞融合度达到90%~95%左右:
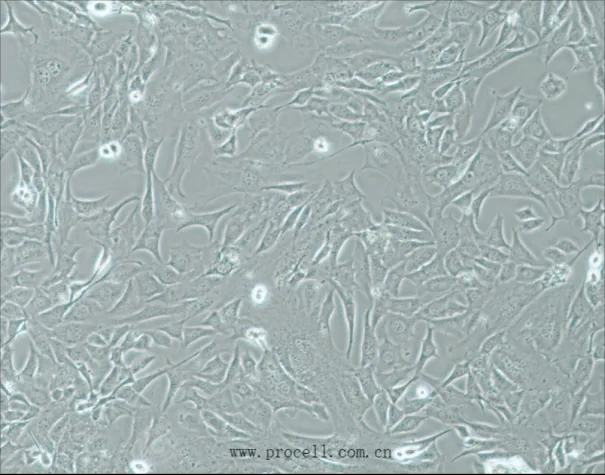
诱导前镜下图
用3T3-L1 (小鼠胚胎成纤维细胞) 成脂诱导分化培养基(PD-031)诱导第8天结果如下:
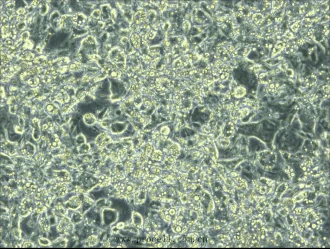
诱导第8天,未染色效果图
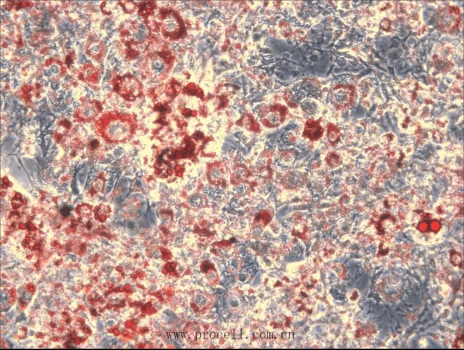
诱导第8天,油红O染色效果图
滴量(大颗脂滴),可适当延长诱导时间。用3T3-L1(小鼠胚胎成纤维细胞)成脂诱导分化培养基诱导第16天结果如下:

诱导第16天,未染色效果图
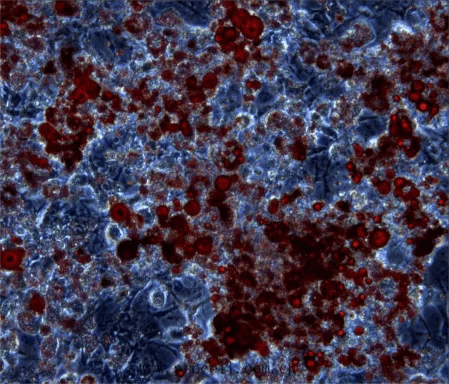
诱导第16天,用油红O染色效果图
诱导注意事项
1、开始诱导时的密度可控制在90%~95%或者刚好长满,注意避免细胞过度饱和导致细胞卷边漂起或者状态不佳,这可能会影响后续的分化效果。
2、铺板需均匀,铺板不均匀可能会导致分化不均匀,分化比例低,分化过程中细胞漂浮。
3、从添加诱导剂开始到分化结束,大概需要2周左右的时间(具体还需根据脂滴出现的情况,适当延长或者缩短诱导时间)。
4、3T3-L1细胞添加诱导剂时,手法要特别轻,诱导试剂需要提前37℃复温后使用,加液时尽量用枪头贴壁逐滴加入,让液体慢慢流下,这样对细胞的冲击最小,否则极容易造成细胞卷边飘起。
5、实验中所使用的溶剂遵循现用现配原则。
6、染色使用的油红O染色液需要按说明书稀释后使用,饱和油红O染色液不容易着色。
实验相关产品推荐:
| 产品名称 | 规格 | 货号 |
| 3T3-L1 (小鼠胚胎成纤维细胞) | 1×10⁶cells/T25培养瓶 | CL-0006 |
| 3T3-L1 (小鼠胚胎成纤维细胞)成脂诱导分化培养基 | 400 mL | PD-031 |
参考文献
[1] Zebisch K , Voigt V , Wabitsch M , et al. Protocol for effective differentiation of 3T3-L1 cells to adipocytes[J]. Analytical Biochemistry, 2012, 425(1):88-90.
[2] 张晓琴. 优化3T3L1细胞成脂诱导模型并初步探讨miR-222-3p对脂肪生成的作用[D]. 湖北中医药大学, 2020.
[3] 王友升, 田元元, 蔡琦玮. 前体脂肪细胞3T3-L1诱导分化条件的优化[J]. 食品科学技术学报, 2014, 32(3):5.



